Brasil
Falta de recursos e estrutura atrasam as 16 vacinas em estudo no Brasil
As três vacinas contra a Covid-19 aprovadas até o momento para uso no Brasil têm origem estrangeira. O imunizante mais recente a conseguir o sinal verde foi o produzido pela americana Pfizer em parceria com a alemã BioNTech. As empresas ainda não fecharam um contrato de venda para o país.
As outras duas são a Coronavac, desenvolvida pela farmacêutica chinesa Sinovac, e o imunizante da AstraZeneca, produzido pela Universidade de Oxford em parceria com a multinacional inglesa. Ambas já estão sendo utilizadas em uso emergencial autorizado pela Anvisa e em parceria com entidades brasileiras, o Instituto Butantan e a Fundação Oswaldo Cruz (Fiocruz), respectivamente.
Na corrida mundial pela imunização, o Brasil também busca produzir sua própria vacina. De acordo com um relatório do Ministério da Saúde, o país tem 16 imunizantes em fase pré-clínica de desenvolvimento. Trata-se de uma etapa ainda inicial, que indica uma dificuldade para que alguma destas vacinas possa ser aplicada ainda em 2021.
Na avaliação do imunologista Eduardo Nolasco, além dos próprios prazos do processo de desenvolvimento, o Brasil enfrenta o obstáculo estrutural: as fábricas de vacina existentes no país estão comprometidas com as produções da Coronavac e da vacina de Oxford.
“É bem provável que essa vacina brasileira tenha que esperar porque a gente não tem outro local para fazer esse desenvolvimento e realizar o teste em humanos”, afirmou.
Nolasco acredita que o ensaio clínico em humanos possa começar no segundo semestre deste ano. Para que isso aconteça, no entanto, será necessário um investimento por parte do governo federal ou da iniciativa privada.
A largada das pesquisas
Na Pesquisa Clínica, antes de serem realizados os testes em seres humanos, há uma fase de investigação dos aspectos de segurança da medicação, com experimentações em animais. Essa fase é conhecida como etapa pré-clínica. O objetivo é obter informações preliminares sobre a atividade farmacológica do medicamento.
Segundo a Agência Nacional de Vigilância Sanitária, mais de 90% das substâncias estudadas nesta fase são eliminadas devido à toxidade aos humanos ou ineficiência terapêutica.
Quando a medicação é aprovada nos testes pré-clínicos, ela está pronta para ser aplicada e estudada em seres humanos. O procedimento científico é então dividido e classificado em quatro fases sequenciais, que têm a função de acumular dados sobre como o corpo humano responde ao novo medicamento.
Fonte: CNN Brasil
-

 CeLelebridades2 semanas atrás
CeLelebridades2 semanas atrásCOLUNA: CeLELEbridades
-

 Ceará2 semanas atrás
Ceará2 semanas atrásSeis pessoas são detidas suspeitas de participar de fraude em um concurso público no interior do Ceará
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásIguatu regulariza R$ 1,63 milhão em consignados não repassados à Caixa e greve é suspensa após acordo mediado pelo TJCE
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásGoverno do Ceará lança programa “Dinheiro na Mão” com R$ 300 milhões em crédito popular sem juros
-
 Noticias2 semanas atrás
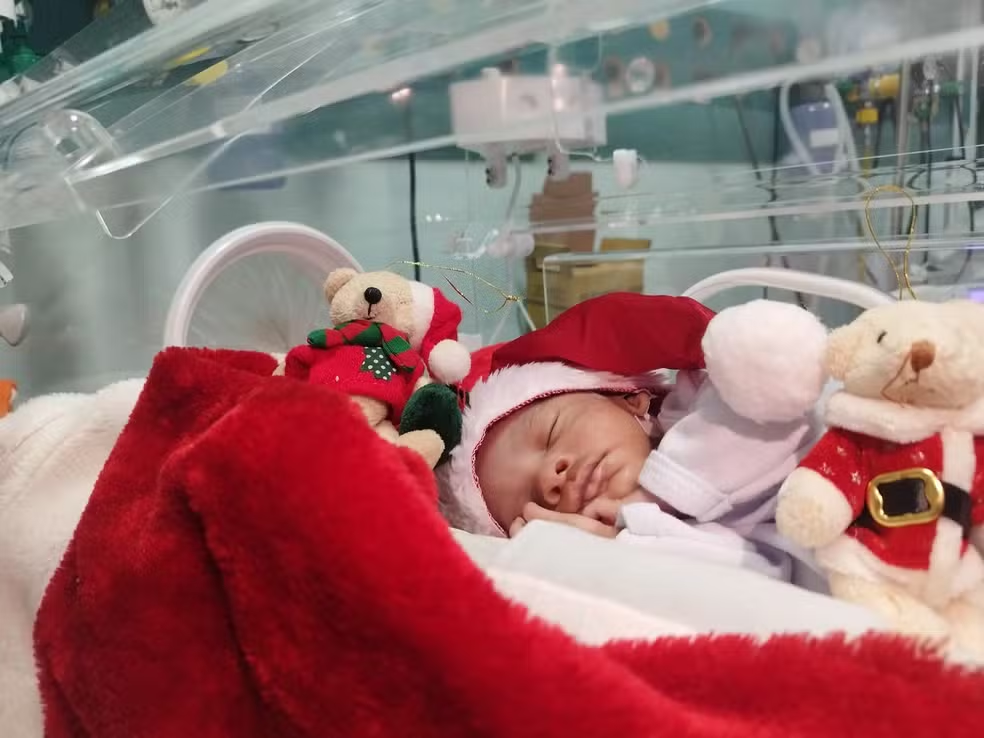
Noticias2 semanas atrásBebês prematuros participam de ensaio fotográfico de Natal em UTI no Pará e emocionam famílias: “trouxe paz ao coração”, diz mãe
-

 Noticias2 semanas atrás
Noticias2 semanas atrásMinistro anuncia renovação automática e gratuita da CNH para motoristas sem infrações
-

 Ceará2 semanas atrás
Ceará2 semanas atrásEnel Ceará recebe multa de quase R$ 20 milhões por falhas no atendimento
-

 Ceará2 semanas atrás
Ceará2 semanas atrásVereadores de Fortaleza aprovam regras para motociclistas por app e desconto no IPVA