Noticias
Anvisa autoriza uso emergencial de coquetel contra a Covid-19

A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta terça-feira, 20, em Brasília, a liberação para uso emergencial de dois medicamentos experimentais da farmacêutica suíça Roche contra a Covid-19, desenvolvidos em parceria com a empresa de biotecnologia americana Regeneron. Os remédios, contendo casirivimabe e imdevimabe (REGN-COV-2), atuam em ligação com a coroa do vírus de forma a impedir sua entrada nas células ainda não infectadas para replicar o material genético, controlando a doença.
A medicação é indicada especialmente para pacientes que estão em idade avançada, obesos, que tenham doença cardiovascular, hipertensão, doença pulmonar crônica, Aids, diabetes, doenças respiratórias, doença renal crônica e doença hepática, entre outras comorbidades e que apresentam alto risco de desenvolver um quadro de progressão para o quadro grave da Covid-19.
Segundo a Anvisa, o medicamento será de uso restrito a hospitais, para uso ambulatorial, ou seja, para pacientes que apresentam sintomas leves da doença, sendo administrado somente com prescrição médica. O medicamento não é recomendado para uso precoce ou preventivo. Também não será permitida a sua comercialização ou venda em farmácias.
O coquetel foi liberado para ser administrado em pacientes a partir de 12 anos, que pesem mais de 40 kg, que não necessitem de suplementação de oxigênio e não apresentem o quadro grave da doença. A aplicação é intravenosa e deve ser administrada logo após a confirmação, por meio de teste viral, até dez dias após o início dos sintomas.
Segundo o gerente-geral de medicamentos e produtos biológicos da Anvisa, Gustavo Silva Santos, o coquetel usa dois anticorpos monoclonais que trabalham para neutralizar o vírus, fornecendo “anticorpos extras” para os pacientes. “A ideia desse produto é que nesses pacientes se mimetize o que seria a resposta imune natural dos anticorpos produzidos em células e que essa produção extra-humana de anticorpos ajude a promover a ação imunológica”, disse.
“[Mas] esse produto não é recomendado para quem já está na situação grave da doença. Para aqueles que já estão internados se observa uma piora no desfecho clínico quando administrado em pacientes hospitalizados com Covid-19 que necessitam de suplementação de oxigênio de alto fluxo ou ventilação mecânica”, acrescentou.
Redução de 70,4% na hospitalização
Santos apresentou dados das pesquisas dos medicamentos e disse que os resultados preliminares em pacientes ambulatoriais, desde o diagnóstico da doença até 29 dias após início do tratamento, mostraram uma redução de 70,4% na hospitalização ou morte relacionadas com a Covid-19.
“O que a gente percebeu foi uma redução significativa e clinicamente relevante de 70,4% no número de pacientes hospitalizados ou morte por quaisquer causas quando comparado com o placebo”, disse. “Ele foi muito bem tolerado, tem um perfil de segurança aceitável.
O pedido para o uso dos medicamentos foi feito pela Roche em 1º de abril. A diretora da Anvisa e relatora do processo de liberação para uso emergencial do medicamento, Meire Sousa Freitas, lembrou que ele já foi aprovado para uso emergencial pela Food and Drug Administration (FDA), agência reguladora dos Estados Unidos, após apresentar bons resultados em pacientes com sintomas leves e moderados da Covid-19.
A Anvisa aprovou um prazo de validade de 12 meses para os medicamentos, por se tratar de uso emergencial. A relatora lembrou que a agência também já liberou, em março, o uso do antiviral Remdesivir, produzido pela biofarmacêutica Gilead Sciences, para o tratamento da Covid-19, e que a nova autorização vai ajudar a aliviar o sistema de saúde do país.
“A autorização emergencial desses anticorpos monoclonais oferece aos profissionais de saúde mais uma ferramenta no combate a essa pandemia”, disse.
Meire lembrou que a autorização é de uso emergencial, por se tratar de um medicamento ainda em desenvolvimento, e que o processo de aprovação do registro definitivo ainda precisa de mais pesquisas e investigação clínica.
Ela alertou ainda que não há pesquisas tratando da aplicação de vacinas contra a Covid-19 em pacientes que foram submetidos ao novo medicamento e que a recomendação é de que o paciente deve aguardar um período de 90 dias após a administração do medicamento para tomar a vacina.
“Atualmente não há dados sobre a segurança e eficácia das vacinas autorizadas pela Anvisa em pessoas que receberam esses anticorpos monoclonais como parte do tratamento da Covid-19. Portanto, antes de se vacinar o paciente deve ser avaliado pelo médico”, finalizou.
Fonte: O Povo
-
 Brasil2 semanas atrás
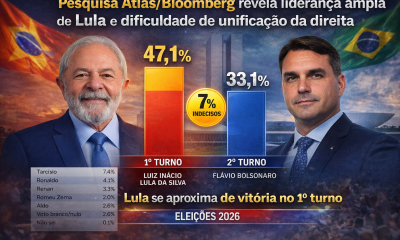
Brasil2 semanas atrásPesquisa Atlas/Bloomberg revela empate em eventual segundo turno, mas aponta Lula próximo de vitória ainda no primeiro
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásSuposta fraude em abastecimento é atribuída a veículos ligados à ex-secretária de Saúde de Acopiara após fim da gestão
-

 Noticias2 semanas atrás
Noticias2 semanas atrásAneel retoma em março discussão sobre renovação do contrato da Enel Ceará
-

 Noticias2 semanas atrás
Noticias2 semanas atrásFortaleza pode ser a primeira capital do país a adotar tarifa zero no transporte coletivo
-

 Iguatu6 dias atrás
Iguatu6 dias atrásEXCLUSIVO: Fumaça, barulho e relatos de doenças: por que fundição segue operando em bairro residencial de Iguatu?
-

 Noticias2 semanas atrás
Noticias2 semanas atrásInstituto Nacional de Meteorologia alerta para chuvas intensas em 38 municípios do Ceará
-

 Noticias1 semana atrás
Noticias1 semana atrásCâmara aprovou projeto de lei que autoriza a venda de medicamentos em redes de supermercados
-

 Noticias2 semanas atrás
Noticias2 semanas atrásBombeiros confirmam 47 mortes após temporais em Juiz de Fora e Ubá, em Minas Gerais