Brasil
Conselho autoriza o uso do derivado da maconha para fins terapêuticos


O detalhamento de quais profissionais poderão receitar o medicamento derivado da maconha, em que circunstâncias e para que tipo de doenças, consta de uma resolução aprovada pelo plenário da entidade
O Conselho Federal de Medicina (CFM) decidiu autorizar neurocirurgiões e psiquiatras a prescreverem remédios à base de canabidiol, nesta quinta-feira, 11, (CBD) para crianças e adolescentes portadores de epilepsias cujos tratamentos convencionais não surtiram efeito.
O detalhamento de quais profissionais poderão receitar o medicamento derivado da maconha, em que circunstâncias e para que tipo de doenças, consta de uma resolução aprovada pelo plenário da entidade. O texto será publicada no Diário Oficial da União, nos próximos dias, e só então a medida entrará em vigor.
Autorização
A importação do produto, que não é fabricado no Brasil, só pode ser feita com autorização da Agência Nacional de Vigilância Sanitária (Anvisa).
Ainda assim, a iniciativa do conselho é classificada como um avanço na luta pela liberação deste tipo de medicamento, já que para obter o aval da agência, pacientes e parentes de quem usa, ou quer utilizar o canabidiol, precisam apresentar receita e laudo médico, além de termo de responsabilidade e formulário de solicitação de importação para remédios controlados.
Muitos médicos se negavam a fornecer a receita e assinar o termo de responsabilidade conjunta por temerem sanções administrativas, já que a prática não era regulamentada pelo CFM.
Dosagens
A Resolução CFM nº 2113 proíbe a prescrição da cannabis sativa (nome científico da maconha) in natura para uso medicinal, bem como de quaisquer outros derivados da planta que não o canabidiol, empregado exclusivamente com fins terapêuticos.
O texto também estabelece as dosagens recomendadas e a forma de monitoramento dos resultados alcançados a partir da prescrição. O grau de pureza da substância e sua forma de apresentação deverão seguir as determinações da Anvisa.
Segurança
O CFM garante ter aprovado a prescrição após avaliar todos os fatores relacionados à segurança do paciente e à eficácia da substância. Após analisar estudos e documentos, o conselho concluiu não haver evidências científicas que comprovem que os canabinóides sejam totalmente seguros e eficazes no tratamento de casos de epilepsia.
Por isso, a prescrição será feita de forma compassiva, ou seja, quando um medicamento novo, ainda não aprovado pela Anvisa, é prescrito exclusivamente para pacientes com doenças graves e sem alternativa terapêutica satisfatória com produtos registrados no país.
O usuário terá que assinar um termo de consentimento em que reconhecerá ter sido informado sobre as alternativas de tratamento e os possíveis efeitos colaterais à saúde, que, entre os já identificados, incluem sonolência, fraqueza e alterações do apetite.
“Até o momento, os estudos realizados em humanos têm poucos participantes e não são suficientes para comprovar sua segurança e efetividade. Diante desse quadro, é importante desenvolver urgentemente pesquisas que possam vir a fornecer evidências robustas, de acordo com as normas internacionais de segurança, efetividade e aplicabilidade clínica do CBD”, ressaltou o presidente do CFM, Carlos Vital Tavares Corrêa Lima, esclarecendo que a resolução deverá ser revista em dois anos, quando serão avaliados novos elementos científicos.
Cadastro para uso
Tanto os médicos que receitarem o canabidiol quanto os pacientes que utilizarem a substância deverão ser previamente cadastrados em um sistema informatizado a ser desenvolvido pelos conselhos regionais de medicina.
A medida permitirá o monitoramento do uso do produto para avaliar sua segurança e possíveis efeitos colaterais.
Pedidos de autorização
Em maio deste ano, a diretoria colegiada da Anvisa colocou em pauta a possibilidade de retirar o canabidiol da relação de substâncias proibidas, inserindo-a na de produtos de uso controlado.
A decisão foi adiada pelo pedido de vistas do processo apresentado por um dos diretores da agência.
Dos 297 pedidos de autorização de importação que recebeu até o último dia 3, a Anvisa autorizou 238, 17 esperam o cumprimento de exigências pelos interessados e 34 estão em análise pela área técnica. O prazo médio das liberações é de uma semana.
Agência Brasil
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásJustiça suspende lei que autorizava venda de terrenos públicos em Iguatu após Ação Popular de vereadores da oposição
-
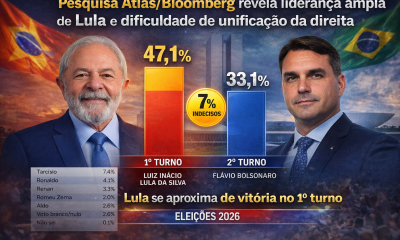
 Brasil2 semanas atrás
Brasil2 semanas atrásPesquisa Atlas/Bloomberg revela empate em eventual segundo turno, mas aponta Lula próximo de vitória ainda no primeiro
-

 Iguatu2 semanas atrás
Iguatu2 semanas atrásSuposta fraude em abastecimento é atribuída a veículos ligados à ex-secretária de Saúde de Acopiara após fim da gestão
-

 Noticias2 semanas atrás
Noticias2 semanas atrásAneel retoma em março discussão sobre renovação do contrato da Enel Ceará
-

 Noticias2 semanas atrás
Noticias2 semanas atrásFortaleza pode ser a primeira capital do país a adotar tarifa zero no transporte coletivo
-

 Iguatu5 dias atrás
Iguatu5 dias atrásEXCLUSIVO: Fumaça, barulho e relatos de doenças: por que fundição segue operando em bairro residencial de Iguatu?
-

 Noticias2 semanas atrás
Noticias2 semanas atrásInstituto Nacional de Meteorologia alerta para chuvas intensas em 38 municípios do Ceará
-

 Noticias2 semanas atrás
Noticias2 semanas atrásBombeiros confirmam 47 mortes após temporais em Juiz de Fora e Ubá, em Minas Gerais




